alifás aminok
Aminok - ammónia-származékok, ahol a hidrogén-atom helyettesítve szénhidrogéncsoportok. Aminok szerint osztályozzák a hidrogénatomok számának szubsztituált a szénhidrogéncsoportok. Megkülönböztetni pervichnyeR-NH2. vtorichnyeR2-NH-N tretichnyeR3 és aminok.
Ismert vegyületek egy kvaterner nitrogénatomot - ammóniumsója - R4N + X-. Ebben az esetben a nitrogén pozitív töltést.
Attól függően, hogy milyen típusú a radikális különböztethető alifás és aromás aminok:
Zsíraminok (zsírsav-aminok)
Izoméria között alifás aminok kapcsolódik izomériát szénhidrogéncsoport, és szubsztituenseket a nitrogénatom.
Sok aminok triviális neveket. A racionális nómenklatúra név aminok kialakítva szénhidrogéncsoportok társított nevekkel a nitrogénatommal és a záróelem -amin:
izopropil-amin, izobutil-amin metil-etil-
Az IUPAC-nómenklatúra egyszerű aminok előállítására racionális nevét. Szabályok értelmében az IUPAC, hogy nevet adunk a végén a szénhidrogéncsoport amin. A szénhidrogén lánc kezdődik a szénatom, amelyhez az amino-csoport: CH3CH2CH2CH-NH-CH 3 1-metil-butil. A jelenlévő más funkciós csoportok az aminocsoport által jelölt előtag: NH2-CH2CH2-OH - 2-amino-etanol.
Eljárások az alifás aminok
1. ammonolízisét halogénezett alkánok.
Történő hevítése során halogén-alkánok alkoholos oldatával ammónia egy lezárt csőben, vegyületek keveréke. A reakcióban ammónia primer aikii-aminokkal halogén-alkánok. Monoalkylamines erősebbek nukleofilek, mint az ammónia; ezek tovább reagálnak haloalkánnal így jelentős mennyiségű szekunder és tercier aminok, és még kvaternizált ammónium-só:

Ammonolízisét halogénezett tárgya nukleofil szubsztitúciós reakciók. Különösen, CH3CH2Cl + NH3 reakció mechanizmus szerint:
Ezért a primer aminok általában úgy kapjuk, más módon.
2. ammonolízisét alkoholok.
Ez áll a csere a hidrogénatomok ammóniával vagy aminnal alkilcsoport. Ez egy fontos módszer szintézisére aminok:
Ammonolízisét alkoholok megvalósított nagy léptékben szintéziséhez rövid szénláncú alifás aminok (metil-és etil-amino). Ezek tüzelőanyagként használt folyékony rakéta motorok és intermedierként a szerves szintézis (előállítására más aminok dimetil anionooobmennyh gyanták és anionos anyagok, peszticidek, karbamátok és ditiokarbamátok).
3. Gabriel szintézis.
Gábriel-szintézis primer aminok lehetővé teszi, hogy ingyenes egy vysokoalkilirovannyh termékek. Alkilezésével ftálimid-káliumot SN2 mechanizmus ad N -alkilftalimid amely könnyen hidrolizálható a megfelelő amin:
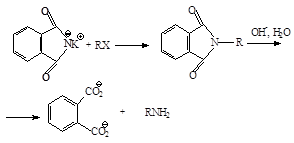
Ftálimidet állítjuk elő, hogy ftálsav-anhidridet ammóniával:
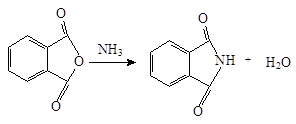
Ftalimid vannak savas tulajdonságokkal delokalizációja a negatív töltést az anion-imid acil két oxigénatom. Ez veszít egy proton a nitrogénatomhoz kapcsolódó reagáltatva kálium-hidroxid-típusú bázissal. ftálimid ion fenti reakcióban keletkezett - anion, amely stabilizálja:

4. A reduktív aminálást a karbonil-vegyületek
Sok karbonilvegyület átalakíthatjuk aminokká a helyreállítási folyamat során a ammónia jelenlétében. Recovery lefolytatása akár katalitikus hidrogénezéssel, vagy nátrium-ciano-NaBH3CN. A mechanizmus E reakció magában foglalja a két fő lépésből áll: az imin és az imin, hogy az amin-hasznosítás:
Ha ammónia helyett használt primer amin, a reakció terméke egy szekunder amin.
5. helyreállítása nitro-alkánok, oximok, nitrilek, amidok
Nitrogén-tartalmú vegyület (nitro-alkánok, oximok, amidok, nitrilek és izonitrilek) hidrogén vagy más redukáló hozamot vagy primer aminok vagy szekunder, vagy ezek keveréke:
Katalizátorok - Pt, Pd, Ni.
3. hasítása savamidok (Hoffmann-átrendeződés).
Amidok alifás és aromás karbonsavak reagálnak lúgos oldatokkal, a jód, bróm- vagy klóratom képezve a primer aminokat. Ez az úgynevezett Hofmann reakció hipohalogenittel nem csak szintetizálni primer aminok, hanem lerövidíti a láncot a szénatomon.

Először rezonancia stabilizált amid ion képződik N-halogénezett-amid (a leírásban N- bróm-amidok), amely a szervezetben instabil lúgos oldatban, és alakul át izocianáttá.
Izocianátok, valamint ezek szén-analógok (ketén) gyorsan reagálnak a vízzel. hidratáció termék karbaminovayakislota. könnyen dekarboxilezünk aminná.
7. Curtiusátrendeződési.
savkloridok, kölcsönhatásban nátrium-aziddal NaN3. így azidok (savazidok), amely, amikor a fűtött, átalakítjuk izocianátok:
Átalakítása acil-azidok a izocianátok, az ábrán látható módon, egy összehangolt folyamat. Ezt a reakciót nevezzük Curtius átrendeződés:
Ezután, izocianátok reagálnak a vízzel és a forma aminok:
Primer és szekunder aminok kialakítására képes intermolekuláris hidrogénkötések. Ezért aminok magasabb forráspontú, mint a nem-poláros vegyületek az azonos molekulatömegű. Alkoholok és karbonsavak alkotnak erősebb hidrogénkötéseket, mint aminok. Mivel a tercier aminok nem tartalmaznak hidrogénatomokat a nitrogénatomon, ha azok nem képeznek hidrogénkötéseket.
Alacsony molekulatömegű aminokat összekeverik vízzel bármilyen arányban.
Alifás aminok. aromás aminok
Kémiai tulajdonságait aminok
1. aminok reakciója savakkal
Ezeket a sókat reagáltatva bázisok vizes oldataival izoláljuk aminok.
A bázikussága aminok határozza meg azt a könnyedséget, amely hasítja az amin proton vízből.
2. aminok alkilezésével a halogénezett alkánok - lásd előadás №31 .. Az utolsó lépésben képződnek kvaterner ammónium-só - a négy szerves csoportok kovalensen kötődnek a nitrogénatomhoz, a pozitív töltés egyensúlyban jelenléte negatív ionok:
Kvaterner ammónium bázisok (fehér kristályos anyag) lúgossága hasonló NaOH, KOH.
4. Acilezés amin (amidok előállítására).
Primer és szekunder aminok anhidridekkel reagálnak, és savhalogenidek amidok előállítására:
Szubsztituált amidok származékaiként nevezzük szubsztituálatlan karbonsavamidokat.
A reakcióban keletkező ekvivalens mennyiségű savval kötődik reagálatlan amin. Egy ilyen eljárás gazdaságtalanná teszi, ha amin nehéz szintetizálni, vagy ez egy drága reagens. Ezért gyakran acilezett aminok reakciójával Schotten-Baumann. előállítására, azzal jellemezve hogy az amint és az acilezőszert jelenlétében vizes nátrium-hidroxid:
Aromás aminok lehetnek pervichnymiArNH2 (anilin, toluidinekből) vtorichnymiAr2NH (difenil-amin), és tretichnymiAr3N (trifenil).
Előállítási módszerei az aromás aminok
1. helyreállítása nitrovegyületek (Zinin reakció).
Redukálószerként használt vas és sósav vagy kénsav, ón és sósav, hidrogén-szulfid és alkálifém-szulfidok, szulfitok, hidrogén katalizátorok jelenlétében. Recovery is elvégezhető elektrolitikus.
Attól függően, hogy a természet a környezet hasznosítás különböző módon. A savas közegben képződő intermediereket és nitrozo-hidroxil-amin-származékok. Az utóbbi lehet beszerezni, mint végtermékeket a csökkentés semleges közegben. Lúgos környezetben, a folyamat sokkal bonyolultabb. Miután a nitrozovegyületek származó azoxy, azovegyületek és ezután, gidrazosoedineniya és végül aminok.
2. ammonolízisét aril-halogenidek (aril-halogenidek ammónia alkilezésével).
Aromás aminok elő aril-halogenidek, és az ammónia:
Az alacsony mobilitása halogénatom, a reakciót kell végrehajtani nagy nyomáson és magas hőmérsékleten, katalizátor jelenlétében - a réz és sói. Csak azokban az esetekben, amikor egy - vagy p-helyzetben a halogénatom erősen elektronegatív csoport, például nitrocsoport, halogénatom könnyen helyettesíthető egy aminocsoport.
3. Reakció Hoffmann.
Aromás aminok is előállíthatók savakból keresztül amid Hofmann reakcióval (lásd. Lektsiyu№31).
4. reakciólépés: a szekunder aromás aminok.
Aromás szekunder aminok melegítésével állítják elő az aromás amin sói:
Másodlagos alifás-aromás aminokat állítjuk elő, hogy primer aromás aminok, alkoholok vagy halogén-származékok.
5. A tercier aminok.
Tercier aromás aminokat állítjuk elő alkilezéssel vagy arilezése egy primer vagy szekunder amin:
Kevesebb hozzáférhető tercier aromás aminokat állítjuk elő, szekunder aminok aril-jodidok jelenlétében rézpor:
Kémiai tulajdonságait az aromás aminok
Aromás aminok kevésbé bázikus karakterű, mint az alifás. Így kb metilamin 4,4 × 10 -5. mivel anilin KB = 3,8 × 10 -10. Csökkentése bázicitása anilin képest alifás aminok magyarázható reakciójával nitrogén magányos elektronpár az aromás gyűrűn elektronok - a konjugáció. Konjugálása csökkenti a képességét, a nem megosztott elektronpár rögzítünk egy proton.
A jelenléte elektronszívó csoportok középpontjában a csökkentése a fő. Például, ahol a bázikussági állandó körülbelül -, m - és p -nitroanilinov alkalmasan 1 × 10 -14. 4 × 10 -12 és 1 × 10 -12. Második vezetőbe második aromás mag ugyancsak észrevehetően csökkenti az lúgossága (a difenil-Kb = 7,6 × 10 -14). A difenil-formák nagy hidrolizálható sóoldatok csak erős savakkal. Trifenil alapvető tulajdonságait gyakorlatilag nem rendelkeznek.
Másrészt, a bevezetése alkilcsoportok (elektron-donor csoportok) növeli a lúgossága (Kb N-metil-anilin és N, N-dimetil-anilin rendre egyenlő 7,1 × 10 -10 és 10 -9 1,1 ×
1. Aromás aminok alkilezését.
Aromás aminok helyettesítheti a hidrogénatomot az aminocsoporton alkilcsoportokkal. Ez a reakció vezet szekunder és tercier aminok:
Alkilezési alkoholokat vagy klór-alkánokat használhatjuk katalizátorként réz sót ammónium-komplexek. Fontos, hogy a folyamat a N- alkilezés soros-párhuzamos annak a ténynek köszönhető, hogy a kapott amin viszont képes reagálni egy alkilezőszerrel. A termékek összetételére függ a reagensek aránya.
2. acilezése aromás aminok.
Az akció a acilezőszerek (savak, anhidridek, savkloridok), a hidrogén atom helyettesítve amino-acil-csoport.
Acilszármazékokat nincs alapvető tulajdonságait. Ezek ellenállnak a oxidáló szerek, és ezért használjuk intermedierként a reakció az aminok jelenlétében oxidánsok (például nitrálással).
3. szintézise azometinekhez (Schiff-bázisok).
Enyhe melegítés aromás primer aminok aromás aldehidek könnyen képez úgynevezett azometinekhez vagy Schiff-bázis:
Az oldást savas Schiff-bázis hidrolizáljuk az aldehid és az amin.
4. az aminok reakciója salétromossavval.
A dinitrogén-sav HONO instabil, de a vizes oldat állíthatjuk elő nátrium-nitrittel hűtés híg savval, például sósavval.
A primer alifás aminok reagálnak hideg vizes salétromsavval képeznek alkildiazonievyh sók. van, amelyet a bomlás keverékéből különböző termékek:
Másodlagos alifás aminok reagálnak salétromossavval képez N-nitrozamin sárga. Ezek a vegyületek, nitrogén-sav-amidok nagyon gyenge bázisok.
N -nitrozodimetilamin (karcinogén!)
Komplex, amely egy elegyet a tercier alkil-aminok salétromossavval.
A legfontosabb képviselői az aromás aminok
Anilin először desztillációjával kapott indigó mésszel (1826). 1842-ben megkapta a Zinin csökkentése nitro. A kis mennyiségben találhatók kőszénkátrány. Az iparilag előállított nitro-benzol katalitikus hidrogénezéssel réz katalizátor a gázfázisban. Anilin nagy mennyiségben jön a színek, ciklohexil kaprolaktám, növényvédő szerek és mások.
p-toluidin széles körben használják a gyártás színezékek, különösen a bíbor.
N, N-dimetil-anilin gyártásához használt festékek és robbanóanyagok.